





L'ÉVAPORATION
Les 5 facteurs qui favorisent l'évaporation
Certaines conditions peuvent favoriser ou accélérer le processus d'évaporation, c'est-à-dire permettre à un plus grand nombre de molécules d'eau de quitter la surface d'eau liquide pour se retrouver dans l'atmosphère.
La température
Un temps chaud permettra à la masse d'eau de se réchauffer et d'augmenter l'énergie
cinétique de ses molécules. Un plus grand nombre de molécules  auront alors l'énergie suffisante pour s'arracher à la surface d'eau (pour s'évaporer). On a tous remarqué que l'eau dans une casserole s'évapore plus vite lorsqu'on la chauffe.
auront alors l'énergie suffisante pour s'arracher à la surface d'eau (pour s'évaporer). On a tous remarqué que l'eau dans une casserole s'évapore plus vite lorsqu'on la chauffe.
Faible
pression atmosphérique
Quand la pression atmosphérique de l'air est faible, l'air pousse moins fort sur la surface de l'eau. Les molécules d'eau auront alors plus de facilité à s'arracher de la surface de l'eau pour se retrouver à l'état de vapeur.
Humidité
relative faible
Lorsque l'humidité relative est faible, l'air est loin d'être saturé en vapeur d'eau. Dans ce cas, il est possible d'ajouter beaucoup plus de vapeur d'eau par évaporation que lorsque l'humidité relative
est forte. (Voir l'explication de l'humidité relative.)
Vent fort
On sait que les vêtements sèchent beaucoup plus rapidement sur la corde à linge lorsqu'il y a un bon vent. Cela est dû au fait que la mince couche d'air
qui se trouve autour des vêtements devient éventuellement saturée de vapeur d'eau à cause de l'évaporation. À mesure  que l'air se rapproche de la saturation, l'évaporation diminue.
Le vent chasse constamment la mince couche d'air autour des vêtements et la remplace. La nouvelle couche d'air contient moins de vapeur d'eau et permet une évaporation plus importante.
que l'air se rapproche de la saturation, l'évaporation diminue.
Le vent chasse constamment la mince couche d'air autour des vêtements et la remplace. La nouvelle couche d'air contient moins de vapeur d'eau et permet une évaporation plus importante.
Grande surface d'eau
Une grande surface d'eau facilite l'évaporation, car dans ce cas, un 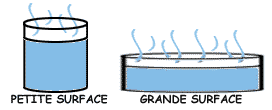 plus grand nombre de molécules d'eau ont la possibilité de se détacher de la masse d'eau.
plus grand nombre de molécules d'eau ont la possibilité de se détacher de la masse d'eau.
|
|
|
|
États | Cycle de l'eau | Évaporation | Humidité | Mesure humidité | Condensation |
|
Comprendre la météorologie
Menu par objectif |
Menu par sujet